|
Forscher
>
Dr. Arthur Schüßler
>
Mykorrhiza-Pilze, DNA-Barcoding und nachhaltige Landwirtschaft
Mykorrhiza-Pilze, DNA-Barcoding und nachhaltige LandwirtschaftUnsichtbare Pilze mit GesichtWir alle kennen den giftigen und farbenfrohen Fliegenpilz. Er geht, wie auch viele unserer Speisepilze, mit den Wurzeln von Bäumen eine so genannte Ektomykorrhiza-Symbiose ein. Aber: Etwa 80 % aller Landpflanzen – inklusive der zehn für die menschliche Ernährung bedeutendsten Nutzpflanzen – werden über eine viel unscheinbarere, kleine Pilzgruppe ernährt. Diese arbuskulären Mykorrhiza-Pilze werden in nachhaltigen Agrarsystemen verstärkt als „Biofertilizer“ angewandt.
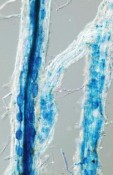
Die meisten Landpflanzen bilden eine sehr intime und ursprüngliche Assoziation mit ganz besonderen Bodenpilzen, die in das Phylum Glomeromycota gestellt wurden [1]. Diese arbuskulären Mykorrhiza (AM) -Pilze sind von enormer Bedeutung für die Pflanzenernährung, für uns aber praktisch unsichtbar. Die asexuell gebildeten Pilzsporen enthalten dutzende, hunderte oder gar tausende von Zellkernen in einem gemeinsamen Zytoplasma. Für die Forschung bedeutet dies, dass es bisher keine Mutanten und auch keine Werkzeuge zur genetischen Manipulation gibt. Und es kommt noch schlimmer: Die Pilze sind obligate Symbionten und können nur aufwändig zusammen mit Pflanzen kultiviert werden. Und dann bildet auch noch ausgerechnet die Modellpflanze der Pflanzenwissenschaften, Arabidopsis thaliana (Brassicaceae) keine AM (und ist damit als Modellpflanze für die Nähstoffaufnahme der meisten Landpflanzen eher ungeeignet). Kaum bekannt und trotzdem völlig normal In natürlichen Ökosystemen ist eine Pflanze ohne Mykorrhiza die Ausnahme. Etwa 95 % aller Landpflanzen nehmen einen Großteil der benötigten anorganischen Nährstoffe über Pilze auf, mit denen sie eine Mykorrhiza (altgriechisch „Pilzwurzel“) ausbilden [2]. Bei Mykorrhizen werden verschiedene Haupttypen unterschieden, wobei die arbuskuläre Mykorrhiza (AM) mit großem Abstand am weitesten verbreitet ist [3]. Der Pilz dringt dabei in die Wurzelrindenzellen ein und bildet dort die namensgebenden Arbuskeln aus (Abb. 1). Äußerlich unterscheidet sich eine kolonisierte Wurzel nicht von einer pilzfreien. Erst durch Färbung wird sichtbar, dass Wurzeln meist vollgepackt mit Pilzhyphen sind. Die Pflanze lockt AM-Pilze über Signalsubstanzen an und baut „Tunnel“ durch ihre Zellen, um die Pilze aktiv in ihre Wurzelrinde zu leiten [4], wo der Nährstoffaustausch stattfindet. Die AM existierte bereits vor mehr als 400 Millionen Jahren (MJ) – möglicherweise hätten Pflanzen das Land vor 450 – 500 MJ ohne ihre Pilzpartner gar nicht besiedeln können [5]. Dies bedeutet, dass wir die komplette Evolution der Landpflanzen nicht isoliert, sondern als Pilzsymbiose interpretieren müssen. Auch globale Stoffflüsse werden durch AM beeinflusst: Bis zu 20 % des fotosynthetisch fixierten CO2 enden als Einfachzucker [6] im Pilzpartner und von dem in Pflanzen enthaltenen Phosphor (P) können mehr als 80 % vom Pilz stammen. Darüber hinaus können AM-Pilze die Resistenz von Pflanzen gegenüber Pathogenen, Trockenstress und Salzstress beträchtlich erhöhen, limitierende Spurenelemente liefern und die Anreicherung von Schwermetallen in Pflanzen vermindern. Warum so wichtig für Pflanzen? Die AM ist sehr dynamisch und die Pflanze kann die Wurzelkolonisation regulieren. Worauf aber gründet die Tatsache, dass AM-Pflanzen bereits bei sehr niedriger P-Düngung eine ähnliche Biomasse erreichen wie nicht mykorrhizierte Pflanzen erst bei hoher P-Düngung? Interessanterweise sind dies vor allem strukturelle Faktoren [3]; ein Grund für die verbesserte Nährstoffaufnahme ist die „Kleinheit“ der Pilze:
a) Das Pilzmyzel ist sehr fein und liefertdadurch eine stark vergrößerte Oberfläche; Wer mit wem und warum? Welcher Pilz vereinigt sich mit welcher Pflanze und unter welchen Bedingungen? Welche Pflanzen bilden überhaupt AM? Es ist einfacher aufzuzählen, welche dies nicht tun: Arten der Ordnung Ericales bilden „erikoide“ Mykorrhiza; die meisten Baumarten in kalten und gemäßigten Klimazonen bilden Ektomykorrhiza (es gibt allerdings auch viele AM ausbildende Baumarten); die meisten Orchideen bilden Orchideen-Mykorrhiza; aber auch einige weitere Gruppen wie zum Beispiel die Kreuzblütler (Brassicaceae; z. B. alle Kohlvarietäten und Raps) bilden keine AM [3]. Wir kennen also zigtausende Pflanzenarten, die eine AM eingehen. Die nur etwa 230 bekannten AM-Pilzarten aber konnten bis vor Kurzem nur Spezialisten anhand der im Boden gebildeten mikroskopisch kleinen Sporen bestimmen. Wir arbeiten daher an molekularbiologischen Methoden zur Charakterisierung [1, 7] und auch zum Nachweis der AM-Pilze im Feld [8 – 10]. Kürzlich haben wir an der Definition des DNA-Barcodes für Pilze mitgewirkt [11]. DNA-Barcodesequenzen müssen für Arten charakteristisch sein und formellen Qualitäts- und Standardisierungskriterien entsprechen; es wurde die internal transcribed spacer (ITS) Region des für die ribosomalen RNA (rRNA)-Gene codierenden Bereiches als primärer Barcode für Pilze festgelegt. Gerade für „unsichtbare“ Mikroorganismen ist eine standardisierte, DNA-basierte Arterkennung enorm wichtig. Wir arbeiten allerdings bereits mit einem erweiterten Barcode, der neben der ITS-Region auch einen Teil des large subunit rRNA (LSU rRNA)-Gens umschließt, womit wir die Artauflösung verbessern [9]. Ein großer Vorteil der gewählten rDNA-Marker ist, dass sie in Feldstudien zum Monitoring angewandt werden können, auch mittels deep sequencing-Methoden. Erst seit Kurzem können wir nun umfassend in die black box „Pilzassoziationen in Boden und Wurzel“ hineinschauen. Anwendung in der Landwirtschaft – Fakt oder Fiktion? Ein besseres Verständnis der AM ist ein nicht zu unterschätzender Faktor für nachhaltige Agrarsysteme. Momentan werden weltweit etwa 70 % des potenziell verfügbaren Trinkwassers für die Landwirtschaft verbraucht und die Kosten für N- (energieintensiv) und P-Dünger (nicht erneuerbare Steinphosphatvorkommen) werden in naher Zukunft stark steigen. Vor diesem Hintergrund wird die Anwendung effizienter Pflanzen und AM-Pilze (als funktionelle Einheit) eine wachsende Rolle spielen. Interessant ist, dass hier gerade auch konventionelle Anbaumethoden profitieren. Bei gleichzeitiger Reduktion von mineralischem P-Dünger (oft um 25 – 50 %) und Anwendung von AM-Pilzen kann man die Kosten bei gleichem Ertrag deutlich verringern (auch für Pestizide, da die Pflanzen robuster sind). In einem am 14.3.2012 im Wissenschaftsteil der Frankfurter Allgemeinen Zeitung als Leitartikel erschienenen Beitrag [12] wird die Bedeutung der Mykorrhiza hervorgehoben, allerdings schließt der Artikel mit der Aussage „In der Landwirtschaft hingegen ist die Pilzlösung noch nicht angekommen. … Bis jetzt noch, in zehn oder zwanzig Jahren könnte das schon anders aussehen“. Wirklich? Wir setzen uns seit einiger Zeit mit angewandten Aspekten auseinander. AM-Pilze werden heute in Schwellenländern verstärkt eingesetzt (begrenzte finanzielle Ressourcen für immer teurer werdenden Mineraldünger) und wir sind zum Beispiel in einem internationalen Forschungsverbund aktiv, der sich der Nutzung von Mikroorganismen für einen effizienteren, aber nachhaltigen Kartoffelanbau in Südamerika widmet. Im Rahmen einer Firmengründung [13] arbeiten wir seit 2011 mit Anwendern und Herstellern von AM-Pilzen zusammen, wobei weiterentwickelte Wurzelorgan- Kultursysteme mittlerweile eine Massenproduktion von AM-Pilzen ermöglichen. Dadurch können diese einfach konzentriert (geringe Transportkosten), konserviert ([Gefrier-]Trocknung) und in verschiedene Produktformulierungen eingebracht werden. Weiterhin können durch die sterilen Produktionsbedingungen Kontaminationenmit Schadorganismen ausgeschlossen werden. In diesem Rahmen wurde 2011 die Saatgut-Beschichtung (seed coating) mit AM-Pilzen für Mais in Süddeutschland getestet (Abb. 3). Im Herbst wurden 3 ha beschichtetes Wintergetreide gesät, im Frühjahr 2012 dann 220 ha Mais kommerziell gecoated; weiter wurden größere Mengen im Kartoffel-und Gemüseanbau eingesetzt. An sieben Standorten werden momentan mit Getreide-Saatgutfirmen Tests durchgeführt, und es gibt weitere Tests mit Braugerste, Soja, Kartoffel etc. mit reduzierter Düngung in der Schweiz, Italien, Österreich und Frankreich. Hier treibt eine pragmatische Weiterentwicklung der Produktions- und Anwendungsmethoden das Feld. Dies ist begrüßenswert, kann aber mit Sicherheit durch ein besseres Verständnis der AM Pilze in Zukunft deutlich optimiert werden. Damit sind wir abschließend wieder bei der Frage: Welche Pilze mit welchen Pflanzen und unter welchen Bedingungen? Molekulare Nachweisverfahren und DNA-Barcodes werden helfen, diese Fragen zu beantworten. Die Entwicklung nachhaltiger, wasser- und nährstoffeffizienter Agrarsysteme (auch die Entwicklung entsprechender transgener Pflanzen) muss die AM jedenfalls berücksichtigen; ansonsten wären solche Ansätze in vielen Fällen wohl zum Scheitern verurteilt.
Literatur beim Autor, siehe auch www.amf-ph Foto: © Dr. Arthur Schüßler |
L&M 5 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |