|
Chromchat
 >
THC-Metaboliten im Urin
>
THC-Metaboliten im Urin
THC-Metaboliten im UrinHoher Durchsatz mit dem ISQ Single Quadrupole GC/MS-SystemDatensicherheit hat in der forensischen Toxikologie einen hohen Stellenwert. Daher müssen neue Geräte vor der Analyse von Kundenproben gründlich getestet werden. Zu den kritischen Parametern, die getestet werden, gehören die Genauigkeit über einen weiten dynamischen Bereich, die Präzision und die Genauigkeit bei physiologischen Wirkstoffkonzentrationen sowie die Robustheit des Instruments, auch bei Verwendung großer Volumina biologischer Flüssigkeiten. Aufgrund des üblicherweise hohen Probenaufkommens, das wenig Zeit für Gerätewartung lässt, hat letzterer Punkt eine zentrale Bedeutung für moderne forensische Toxikologie-Laboratorien. Im Hinblick auf diese Erwägungen wurde das kürzlich eingeführte Thermo Scientific ISQ™ Single Quadrupole GC/MS-System eingehend auf seine Linearität, Genauigkeit, Präzision und Robustheit getestet. Als Prüfsubstanz wurde 11-Nor-9-carboxy-?9- tetrahydrocannabinol (THCA) in einerUrinmatrix gewählt. Aufgrund des hohen Anteils an positiven Testergebnissen für THC müssen viele forensische Toxikologie-Labore große Probenmengen bewältigen [1]. Diese Methode wurde am ISQ GC/MS auf Grundlage der Richtlinien validiert, die von der United States Substance Abuse and Mental Health Services Administration (SAMHSA), dem College of American Pathologists (CAP), der Society of Forensic Toxicologists (SOFT) und der European Workplace Drug Testing Society (EWDTS) veröffentlicht wurden. Die Methodenvalidierung wurde unter Verwendung extrahierter und derivatisierter Urinproben ausgeführt und umfasste Linearität, Verschleppung, Präzision innerhalb eines Tages, Tag-zu-Tag-Präzision sowie Robustheit. Methoden
Die Methodenparameter für die Probenvorbereitung und die instrumentelle Analyse waren identisch mit den zuvor an dem Thermo Scientific DSQ II™ GC/MS-System entwickelten Parametern [2]. Alle Validierungen wurden mit einem Probevolumen von 3 ml Urin durchgeführt. Die Derivatisierung des Urins erfolgte unter Verwendung von Thermo Scientific BSTFA mit 1 % TMCS (Bestell-Nr.: TS–38834). Zur Probenextraktion wurden Thermo Scientific HyperSep ™ Verify-CX Festphasenextraktions- Säulen (200 mg, 10 mL, Bestell-Nr.: 60108–742) eingesetzt. Als interner Standard wurde THCA-D9 eingesetzt. Alle Chargen, einschließlich der Probenserie zur Bestimmung der Robustheit, enthielten eine Ein-Punkt-Kalibrierprobe in Matrix (bei 15 ng/mL). Weiterhin waren Proben für die Qualitätskontrolle mit THCA-Konzentrationen bei 40 % und 125% des Kalibrators (entspricht 6 ng/mL bzw. 18,75 ng/ml), sowie eine Negativkontrolle aus blindwertfreiem Urin mit THCA-D9 enthalten. Die Probenserien zur Bestimmung der Robustheit bestanden jeweils aus 50 Injektionen von Urinextrakten, welche mit dem oben beschriebenen Verfahren hergestellt worden waren, sowie der Kalibrierproben und der Qualitätskontrollen zur Überprüfung der Systemeignung. Täglich wurde ein vollständiges Autotune durchgeführt, und die entsprechenden Tuning-Berichte wurden auf die Konformität mit einschlägigen Branchenrichtlinien überprüft. Hierbei wurden die Peakformen und die wichtigsten Isotopenverhältnisse des Kalibriergases (PFTBA), die Detektorverstärkung sowie der Luft- und Wasseruntergrund berücksichtigt. Ergebnisse Linearität von 1,5 ng/ml bis 3000 ng/ml (Abb. 1) THCA Bestimmungsgrenze bei 1,5 ng/ml (Abb. 2) THCA Retentionszeit von 1,8 Minuten und GC-Zykluszeit von 5,65 Minuten (entspricht ca 11 Proben pro Stunde) Präzision innerhalb einer Probenserie und Präzision zwischen verschiedenen Probenserien < 4 % VK (Variationskoeffizient) bei 6 ng/ml und 18,75 ng/ml Stabiles Geräte-Tuning und alle Qualitätskontrollen innerhalb der Grenzen bei der Messung von 5000 Urinproben, ohne dass Wartungsarbeiten am Massenspektrometer durchgeführt werden mussten Fazit
Linearität, Präzision und Robustheit einer Nachweismethode für 11-Nor-9-carboxy-?9-tetrahydrocannabinol in einer Urinmatrix wurden unter Verwendung eines ISQ Single Quadrupole GC/MSSystems unter Einhaltung der Kriterien zur Methodenvalidierung von SAMHSA, CAP, SOFT und EWDTS validiert. Der lineare Bereich lag zwischen 1,5 ng/ml und 3000 ng/ml. Verschleppungseffekte konnten in diesem Bereich nicht nachgewiesen werden. Dabei betrug der Variationskoeffizient für die Präzision innerhalb einer Probenserie und zwischen verschiedenen Probenserien weniger klaus.schrickel@thermofisher.com
Literatur |
L&M 6 / 2010
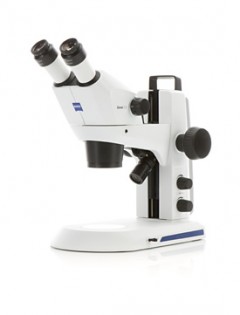
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |