|
Chemie
 >
Makrolide aus marinen Organismen
>
Makrolide aus marinen Organismen
Makrolide aus marinen OrganismenMit dem von R. B. Woodward geprägten Begriff „Makrolide“ bezeichnet man makrozyklische Naturstoffe mit einer Lacton-Gruppierung. Häufig handelt es sich dabei um Stoffwechselprodukte von Bakterien und Pilzen. Die Biosynthese dieser Substanzen verläuft über den sog. Polyketidweg, wobei Acetyl- oder Malonyl-Einheiten miteinander verknüpft werden. Auch marine Organismen produzieren solche Sekundärmetabolide mit häufig ungewöhnlichen und teilweise unerwarteten biologischen Eigenschaften.
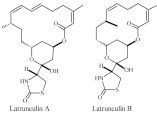
Die ersten marinen Makrolide – die Latrunculine – wurden aus dem im Roten Meer vorkommenden Schwamm Latruncula magni fica isoliert und 1980 beschrieben. Aufgefallen war, dass der Schwamm von Fischen weder beschädigt noch abgeerntet wird. Die Substanzen wurden aus der rötlichen Flüssigkeit isoliert, die aus dem Schwamm beim Zerdrücken austritt. Die Latrunculine enthalten 14- bis 16-gliedrige Ringe und überdies eine seltene Thiazolidinon- Einheit. Latrunculin A (Abb. 1) wurde auch in anderen Schwämmen und in der Nacktschnecke Chromodoris lochi gefunden. Die Latrunculine gehören zu einer Reihe von marinen Makroliden mit zytostatischen und actinbindenen Eigenschaften. In den 1990er-Jahren wurden weitere, strukturell komplexe sowie eng miteinander verwandte 22- bis 44-gliedrige Makrolide isoliert und identifiziert. Dazu gehören die Swinholide aus dem Schwamm Theonella swinhoei, die Scytophicine aus dem Cyanobacterium Scytonema pseudohofmanni, die Sphinxolide aus den Schwämmen Neosiphonia superstes und Reidispongia coreulea, die Mycalolide aus dem Schwamm der Gattung Mycale und der Steinkoralle Tubastrea faulkneri, die Aplyronine aus dem Seehasen Aplysia kurodai u.a. Bemerkenswert ähnlich sind die Seitenketten von Scytopycin, Aplyronin A, Sphinxolid, Mycalolid A, und Ulapualid (Isomeres zu Mycaloid A), sie tragen jeweils eine endständige N-Methylvinylformamidgruppe (Abb. 2). Auch einige Stereozentren in den Seitenketten sind gleich konfiguriert. So besitzen die C21-C32- und die C23-C34- Seitenketten von Scytophycin und Aplyronin A dieselbe Konfiguration. Die Scytophycine wurden als einzige Verbindungen aus terrestrischen Cyanobakterien isoliert. Die Wechselwirkung mit Actin Alle Substanzen wechselwirken mit dem Aktin des Cytoskaletts eukariotischer Zellen. Dieses spielt eine entscheidende Rolle bei der Festlegung der Zellform und bei zellulären Prozessen wie Bewegung, Teilung, Adhäsion und intrazellulären Transport. In den Zellen werden Actinstrukturen in einem reversiblen Prozess permanent aus monomerem, globulärem G-Actin zu polymeren, helikalen Strukturen (F-Actin) auf- und wieder abgebaut. Die Laturnculine A und B waren die ersten marinen Makrolide mit definierten actin-bindenden Eigenschaften. Sie bilden einen 1 : 1-Komplex mit G-Actin und verhindern damit seine Polymerisation. Außerdem depolymerisieren sie das F-Actin. Mit Laturn culin A wurde die wichtige Funktion des Actin-Cytoskeletts bei der Spindelorientierung aufgeklärt (Y. Gachet et al.; Nature 2001, 412, 352-355). Der cytostatischen Effekt Die bemerkenswert extreme, zytostatische Wirkung der marinen Makrolide gegenüber einer Reihe menschlicher Krebszelllinien ist erheblich. Einige Substanzen wie Sphinxolid und die Ulapualide zeigen eine starke Zytotoxizität gegen L1210- und/oder KB-Zellen mit IC50-Werten zwischen ngmL–1 und pgmL–1. Sie wirken toxisch gegen B16-Melenomzellen, wobei die IC50-Werte bei 0,5 ?1,0 ngmL–1 liegen. Hervorzuheben ist das Aplyronin A. Es wirkt in vivo mit einem Treatment-to-Control-Verhältnis von 200–500 % ungewöhnlich stark gegen P388-Leukämie, Colon- 26-Karzinom, Lewis-Lungenkarzinom und B16-Melanom und hat damit das Potenzial für klinische Anwendungen. Vergleicht man die Menge an Actin mit der Konzentration an Makrolidmolekülen, dann kann die signifikante Antitumor-Aktivität nicht alleine auf der Wechselwirkung mit Actin beruhen. Über die Wirkart und den Wirkort dieser Verbindungen ist bisher wenig bekannt, obwohl sie ein derart enormes Potenzial in der Krebstherapie besitzen. Amplyronin A in Aktion Neue Untersuchungen der Arbeitsgruppe um H. Kigoshi (Angew. Chem. 2011,123, 10045-100488) erlauben inzwischen einen genaueren Einblick in die Struktur-Wechselwirkungsbeziehungen vom Amplyronin A (ApA). ApA (Abb. 3) besteht aus zwei charakteristischen Teilen, dem Maktolidteil C1–C23 und dem aliphatischen Rest C24–C34. Der aliphatische Teil ist zuständig für die effektive Actin-Depolymerisation, während für die zytostatische Wirkung die Trimethylserineinheit an C7, die OH-Funktion an C9 und die konjugierte Dieneinheit im Makrolactonring verantwortlich sind. Die Röntgenstruktur zeigt den C24–C34- Teil von ApA, eingebettet in eine hydrophobe Tasche des Actins, während die terminale N-Formylenamidgruppe mit den in das Actin eingelagerten Wassermolekülen interagiert. Auch andere Makrolide wie das Sphinxolid bilden analoge Actin/Makrolid-Komplexe Die für die Zytotoxizität mit verantwortliche Trimethylseringruppe ragt aus dem Actin/ApA-Komplex heraus. Diese spezifische, dreidimensionale Anordnung bewirkt, dass andere Proteine an den Actin/ApA-Komplex gebunden werden können und damit zum zytostatischen Effekt beitragen. Die von den Autoren beschriebenen Derivate von ApA mit einem über Polyethylenglykol verknüpften Biotin zeigen ebenfalls hohe Zytotoxizität und führen zum Zerfall von Actin in Tumorzellen. Mit den biotinylierten Derivaten von ApA stehen Sonden zur Verfügung, mit denen Actin und aktinähnliche Proteine lokalisiert werden können. Verfügbarkeit Wegen ihrer interessanten Strukturen, der Fülle von Stereozentren und der medizinischen Bedeutung ist das Interesse an diesen Substanzen groß. Das begrenzte Vorkommen in den Wirtsorganismen verbietet eine Isolierung aus den natürlichen Quellen und deshalb gilt die Aufmerksamkeit vornehmlich der Synthese dieser Verbindungen. K.-S. Yeung und I. Paterson haben vor einiger Zeit in einer Übersichtsarbeit die Totalsynthesen von Scytophycin C, ApA, Mycalolid A und Swinholid beschrieben (Angew. Chem. 2002, 114, 4826-4847). Dabei zeigt sich, welch enormer Aufwand bei diesen vielstufigen Synthesen betrieben werden muss. Um alle Abbildungen zu sehen, laden Sie sich bitte das PDF (oben rechts) herunter. Foto: © Dr. Gehard Schilling |
L&M 1 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |